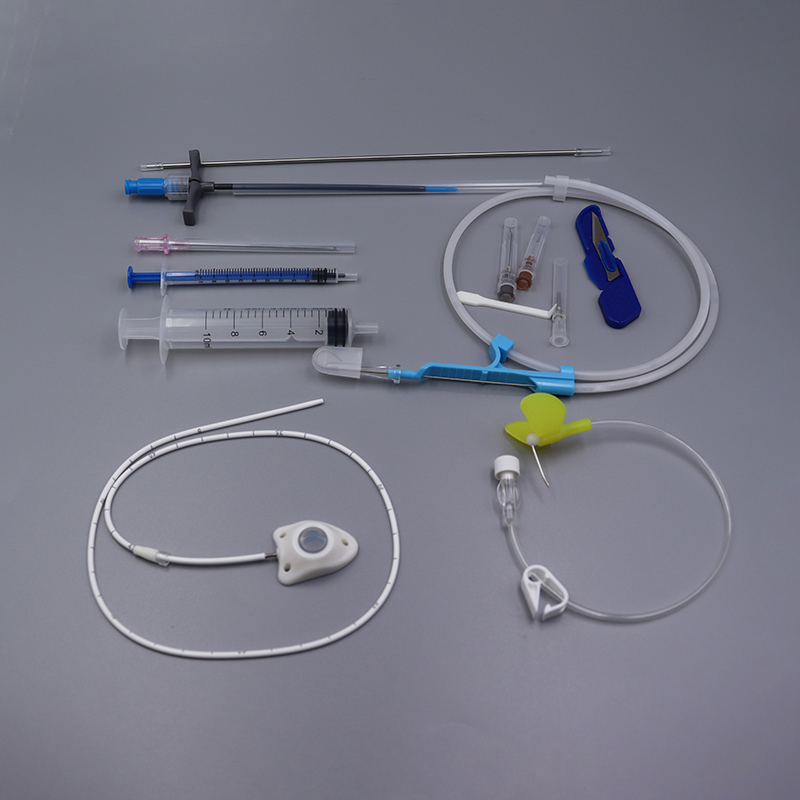
[Användning] Den vaskulära enhetenimplanterbar portär lämplig för guidad kemoterapi för en mängd olika maligna tumörer, profylaktisk kemoterapi efter tumörresektion och andra lesioner som kräver långvarig lokal administrering.
[Specifikation]
| Modell | Modell | Modell |
| I-6,6Fr×30 cm | II-6,6Fr×35 cm | III- 12,6 Fr × 30 cm |
【Prestanda】Injektionshållarens självtätande elastomer möjliggör 22GA-nålar i implanterbar port för 2000 punkteringar. Produkten är tillverkad helt av medicinska polymerer och är metallfri. Katetern är röntgendetekterbar. Steriliserad med etylenoxid, för engångsbruk. Anti-reflux-design.
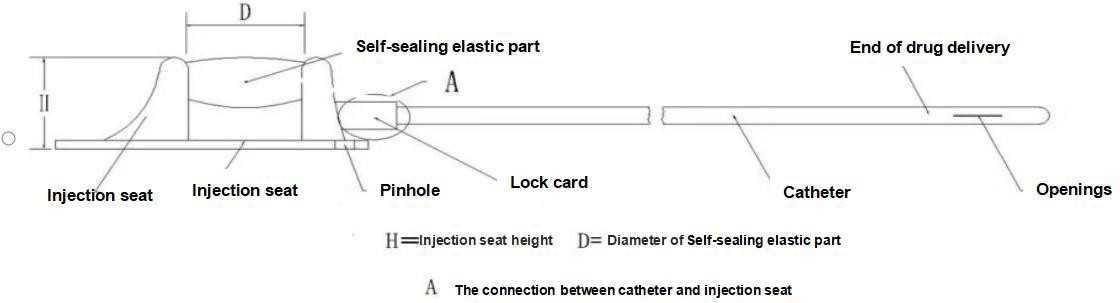
【Struktur】Denna anordning består av ett injektionssäte (inklusive självtätande elastiska delar, punkteringsbegränsningsdelar, låsklämmor) och en kateter, och typ II-produkten är utrustad med en låsklämma. Katetern och det självtätande elastiska membranet i den implanterbara läkemedelsleveransanordningen är tillverkade av medicinskt silikongummi, och de andra komponenterna är tillverkade av medicinsk polysulfon. Följande diagram presenterar produktens huvudstruktur och komponentnamn, med typ I som exempel.
【Kontraindikationer】
1) Psykisk eller fysisk olämplighet för kirurgi under allmänna förhållanden
2) Svåra blödnings- och koagulationsrubbningar.
3) Antal vita blodkroppar lägre än 3×109/L
4) Allergisk mot kontrastmedel
5) Kombinerat med svår kronisk obstruktiv lungsjukdom.
6) Patienter med känd eller misstänkt allergi mot materialen i enhetens förpackning.
7) Förekomst av eller misstanke om enhetsrelaterad infektion, bakteriemi eller sepsis.
8) Strålbehandling på det avsedda insättningsstället.
9) Bilddiagnostik eller injektion av emboliska läkemedel.
【Tillverkningsdatum】 Se produktetikett
【Utgångsdatum】 Se produktetiketten
【Appliceringsmetod】
- Förbered den implanterbara portanordningen och kontrollera om utgångsdatumet har passerats; ta bort innerförpackningen och kontrollera om förpackningen är skadad.
- Använd aseptiska tekniker för att öppna innerförpackningen och ta ut produkten innan användning.
- Användningen av implanterbara portanordningar beskrivs separat för varje modell enligt följande.
TypⅠ
- Spolning, avluftning, läckagetestning
Använd en spruta (nål för implanterbar portanordning) för att punktera den implanterbara portanordningen och injicera 5–10 ml fysiologisk koksaltlösning för att spola injektionssätet och kateterlumen och tömma ut den. Om ingen eller långsam vätska hittas, vrid kateterns läkemedelsleveransände (distala änden) för hand för att öppna läkemedelsleveransporten. Vik sedan ihop kateterns läkemedelsleveransände och fortsätt trycka på koksaltlösning (trycket får inte överstiga 200 kPa). Kontrollera om det finns läckage från injektionssätet och kateteranslutningen. När allt är normalt kan katetern användas.
- Kanylering och ligering
Enligt den intraoperativa undersökningen, för in katetern (läkemedelsleveransänden) i motsvarande blodkärl beroende på tumörens placering, och använd icke-absorberbara suturer för att korrekt ligera katetern till kärlet. Katetern ska vara korrekt ligerad (två eller fler passager) och fixerad.
- kemoterapi och försegling
Intraoperativt kemoterapiläkemedel kan injiceras en gång enligt behandlingsplanen; det rekommenderas att injektionssätet och kateterlumen spolas med 6–8 ml fysiologisk koksaltlösning, följt av 3–5 ml. Katetern förseglas sedan med 3–5 ml heparinsaltlösning vid 100–200 U/ml.
- Fixering av injektionssäte
En subkutan cystisk hålighet skapas på en stödpunkt, som är 0,5 cm till 1 cm från hudytan, och injektionssätet placeras i håligheten och fixeras, och huden sys fast efter strikt hemostas. Om katetern är för lång kan den rullas ihop till en cirkel i den proximala änden och fixeras ordentligt.
Typ II
1. Spolning och avluftning
Använd en spruta (nål för implanterbar portanordning) för att injicera saltlösning i injektionssätet respektive katetern för att spola och avlägsna luften i lumen och observera om ledningsvätskan är jämn.
2. Kanylering och ligering
Enligt den intraoperativa undersökningen, för in katetern (läkemedelsleveransänden) i motsvarande blodkärl beroende på tumörens placering, och ligatera katetern ordentligt med kärlet med icke-absorberbara suturer. Katetern ska vara ordentligt ligerad (två eller fler passager) och fixerad.
3. Anslutning
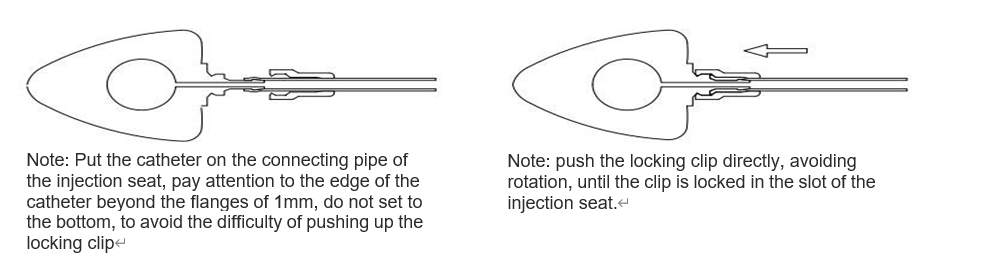
Bestäm den erforderliga kateterlängden utifrån patientens tillstånd, skär av överskottet från kateterns proximala ände (icke-doseringsänden) och för in katetern i injektionssätets anslutningsslang med hjälp av
Använd låsklämmans förstärkare för att trycka låsklämman ordentligt mot injektionshållaren. Dra sedan försiktigt katetern utåt för att kontrollera att den sitter ordentligt fast. Detta görs enligt anvisningarna i
Figur nedan.
4. Läckagetest
4. När anslutningen är klar, vik och stäng katetern på baksidan av låsklämman och fortsätt att injicera saltlösning i injektionssätet med en spruta (nål för implanterbar läkemedelsleveransanordning) (tryck över 200 kPa). (tryck högst 200 kPa), observera om det finns läckage från injektionsblocket och katetern.
anslutning, och använd endast efter att allt är normalt.
5. Kemoterapi, förseglingsrör
Intraoperativt kemoterapiläkemedel kan injiceras en gång enligt behandlingsplanen; det rekommenderas att spola injektionsbasen och kateterlumen med 6~8 ml fysiologisk saltlösning igen och sedan använda 3 ml~5 ml fysiologisk saltlösning.
Katetern förseglas sedan med 3 till 5 ml heparinlösning vid 100 U/ml till 200 U/ml.
6. Fixering av injektionssäte
En subkutan cystisk kavitet skapades på en stödpunkt, 0,5 cm till 1 cm från hudytan, och injektionssätet placerades i kaviteten och fixerades, och huden syddes fast efter strikt hemostas.
Typ Ⅲ
En spruta (specialnål för implanterbar portanordning) användes för att injicera 10 ml ~ 20 ml normal saltlösning i den implanterbara läkemedelsavgivningsanordningen för att spola injektionssätet och kateterns hålighet, och avlägsna luften i håligheten, och observera om vätskan var diskret.
2. Kanylering och ligering
Enligt den intraoperativa undersökningen, för in katetern längs bukväggen, och den öppna delen av kateterns läkemedelsleveransände ska gå in i bukhålan och vara så nära tumörmålet som möjligt. Välj 2-3 punkter för att ligera och fixera katetern.
3. kemoterapi, tätningsrör
Intraoperativt kemoterapiläkemedel kan injiceras en gång enligt behandlingsplanen, och sedan förseglas röret med 3–5 ml heparinlösning på 100–200 U/ml.
4. Fixering av injektionssätet
En subkutan cystisk kavitet skapades på en stödpunkt, 0,5 cm till 1 cm från hudytan, och injektionssätet placerades i kaviteten och fixerades, och huden syddes fast efter strikt hemostas.
Läkemedelsinfusion och vård
A.Strikt aseptisk drift, korrekt val av injektionssätets placering före injektion och noggrann desinfektion av injektionsstället.B. Vid injektion, använd en nål för implanterbar portanordning, en spruta på 10 ml eller mer, där vänster pekfinger vidrör punkteringsstället och tummen spänner huden samtidigt som injektionssätet fixeras. Håll sprutan vertikalt i nålen med höger hand, undvik att skaka eller rotera. Injicera långsamt saltlösning 5 ml ~ 10 ml när det känns som att du faller och nålspetsen sedan vidrör botten av injektionssätet. Kontrollera om läkemedelsleveranssystemet är slätt (om det inte är slätt bör du först kontrollera om nålen är blockerad). Observera om det finns någon upphöjning av den omgivande huden när du trycker.
C. Tryck långsamt in kemoterapeutiska läkemedlet efter att ha bekräftat att det inte finns något fel. Var uppmärksam under tryckprocessen på om den omgivande huden är upphöjd eller blek, och om det finns lokal smärta. Efter att läkemedlet har tryckts in bör det hållas i 15–30 sekunder.
D. Efter varje injektion rekommenderas det att spola injektionssätet och kateterlumen med 6–8 ml fysiologisk koksaltlösning och sedan försegla katetern med 3–5 ml heparinlösning (100 U/ml–200 U/ml). När de sista 0,5 ml heparinlösning har injicerats bör läkemedlet tryckas in samtidigt som det dras tillbaka, så att läkemedelsintroduktionssystemet fylls med heparinlösning för att förhindra läkemedlets kristallisering och blodkoagulering i katetern. Katetern bör spolas med heparinlösning en gång varannan vecka under kemoterapiintervallet.
E. Efter injektionen, desinficera nålsögat med medicinskt desinfektionsmedel, täck det med sterilt förband och var noga med att hålla det lokala området rent och torrt för att förhindra infektion vid punkteringsstället.
F. Var uppmärksam på patientens reaktion efter läkemedelsadministrering och observera noga under läkemedelsinjektionen.
【Varning, varning och suggestivt innehåll】
- Denna produkt är steriliserad med etylenoxid och är giltig i tre år.
- Läs bruksanvisningen före användning för att säkerställa säkerheten vid användning.
- Användningen av denna produkt måste uppfylla kraven i relevant praxis och föreskrifter inom sjukvårdssektorn, och införande, användning och borttagning av dessa enheter bör begränsas till legitimerade läkare. Insättning, användning och borttagning av dessa enheter är begränsad till legitimerade läkare, och vård efter analys bör utföras av kvalificerad medicinsk personal.
- Hela proceduren måste utföras under aseptiska förhållanden.
- Kontrollera produktens utgångsdatum och innerförpackningen för skador före ingreppet.
- Produkten kan orsaka biologiska faror efter användning. Följ godkänd medicinsk praxis och alla relevanta lagar och förordningar för hantering och behandling.
- Använd inte överdriven kraft under intubation och för in artären noggrant och snabbt för att undvika vasospasm. Om intubation är svår, använd fingrarna för att vrida katetern från sida till sida medan du för in slangen.
- Kateterns längd i kroppen bör vara lämplig. För lång kateter gör att den lätt böjs i vinkel, vilket leder till dålig ventilation. För kort kateter gör att patienten vid våldsamma aktiviteter riskerar att lossna från kärlet. Om katetern är för kort kan den lossna från kärlet när patienten rör sig kraftigt.
- Katetern bör föras in i kärlet med mer än två ligaturer och med lämplig åtdragning för att säkerställa smidig läkemedelsinjektion och för att förhindra att katetern glider av.
- Om den implanterbara portanordningen är av typ II måste anslutningen mellan katetern och injektionssätet vara fast. Om intraoperativ läkemedelsinjektion inte krävs, bör injektion med normal saltlösning användas för bekräftelse innan huden sutureras.
- Vid separering av det subkutana området bör tät hemostas utföras för att undvika bildandet av lokalt hematom, vätskeansamling eller sekundär infektion efter operationen; den vesikulära suturen bör undvika injektionssätet.
- Medicinska α-cyanoakrylatlim kan skada injektionsbasmaterialet; använd inte medicinska α-cyanoakrylatlim vid behandling av det kirurgiska snittet runt injektionsbasen. Använd inte medicinska α-cyanoakrylatlim vid hantering av kirurgiska snitt runt injektionsbasen.
- Var extremt försiktig för att undvika läckage från katetern på grund av oavsiktlig skada från kirurgiska instrument.
- Vid punktering ska nålen föras in vertikalt, en spruta med en kapacitet på 10 ml eller mer ska användas, läkemedlet ska injiceras långsamt och nålen ska dras ut efter en kort paus. Trycket ska inte överstiga 200 kPa.
- Använd endast specialnålar för implanterbara läkemedelsleveransanordningar.
- När en längre infusion eller läkemedelsutbyte krävs är det lämpligt att använda en implanterbar läkemedelsadministreringsanordning för engångsbruk med en speciell infusionsnål eller T-rör för att minska antalet punkteringar och minska påverkan på patienten.
- Minska antalet punkteringar, minska skadorna på patientens muskler och självtätande elastiska delar. Under perioden då läkemedelsinjektionen avbryts krävs antikoagulantia injektion en gång varannan vecka.
- Denna produkt är en steril, pyrogenfri engångsprodukt som förstörs efter användning. Återanvändning är strängt förbjuden.
- Om innerförpackningen är skadad eller om produktens utgångsdatum har passerat, vänligen returnera den till tillverkaren för kassering.
- Antalet punkteringar för varje injektionsblock bör inte överstiga 2000 (22Ga). 21.
- Minsta spolvolym är 6 ml
【Lagring】
Denna produkt ska förvaras i en giftfri, icke-frätande gas, välventilerad, ren miljö och förhindras från extrudering.
Publiceringstid: 25 mars 2024